Kimya - maddənin tərkibini, quruluşunu, xassələrini
,çevrilməsini və bu çevrilmələr zamanı baş verən hadisələri öyrənən təbiət elmidir.[1]Kimyanın mühüm vəzifələrinə zəruri maddələrin
alınması, maddələrin çevrilməsini və bu çevrilmələri müşahidə edən hadisələri
öyrənmək, ətraf mühtin mühafizəsi və s. kimi vəzifələr aiddir.
Kimyanın tədqiqat obyekti maddələr - atom və molekullardır. Bunlar kimyəvi hissəciklər adlanırlar. Onların ölçüsü 10-10 – 10-6metr arasında olur. Bundan kiçik ölçülü hissəcikləri fizika öyrənir. Həmin hissəciklər mikrohissəciklər adlanır. Ölçüsü iri olan hissəciklərdə baş verən prosesləri də fizika öyrənir.
Adı kimyəvi üsullarla daha bəsit
maddələrə ayırmanın mümkün olmadığı təbii
və süni
maddələr. Kimyəvi
elementlər bir-biri
ilə birləşərək
bizi əhatə edən aləmin
bütün
mürəkkəb maddələrini əmələ gətirir. Hər kimyəvi , nüvəsində eyni
sayda elektrik yükü və atom örtüyündə eyni
sayda elektron olan atomlardan yaranmışdır. Atomların nüvəsi sayca həmin
elementin atom
nömrəsinə bərabər
protondan və müxtəlif
sayda neytrondan ibarətdir. Eyni elementin kütlə ədədləri müxtəlif olan növlərinə izotopdeyilir. Kimyəvi
elementlərin çoxunun
təbiətdə iki və ya
daha artıq
izotopu var. 81 elementin 276 sabit və 1500-ə yaxın radioaktiv izotopu məlumdur. Yer üzərində təbii elementlərin izotop tərkibi, adətən, sabit
olduğundan hər
elementin atom
kütləsi, demək olar ki, daim
sabit qalır
və elementin ən mühüm xarakteristikalarından biridir.
Hələlik
elmə məlum
olan Kimyəvi
elementlərin sayı 176-dır
(2017).Bu elementlərin 118 -i stabil nuklidlərdir.Və bu elementlərin 118-i" İUPAK" tərəfindən
adlandırılmışdır.Onların əksəriyyəti radioaktiv deyil və təbiətdə mövcud
olan bütün bəsit
və mürəkkəb
maddələri əmələ gətirir. Bəsit
maddə - elementin sərbəst haldakı formasıdır.Bu o deməkdir
ki elementlər birləşib
bir və ya
bir necə bəsit maddə əmələ gətirir.Bu hadisə allotropya
adlanır.Allotropya
iki səbəbdən
baş verə bilər. I.Kristal quruluşda
olan müxtəliflik. II.Molekulda olan atomların sayının müxtəlifliyi. Oksigendə allotropya ıı səbəbə görə ancaq
fosforda isə ı səbəbə görə baş verir.
Kimya sözünün nə vaxt meydana gəlməsi və ilk olaraq
hansı mənanı ifadə etməsini dəqiq təyin etmək mümkün deyil. Bir çox kimya
tarixçiləri öz hipotezlərini təklif etsələr də, vahid bir fikir
formalaşmadı.
XVII əsrin başlanğıcından «kimya», «kimyaçı» məvhumları elmi ədəbiyyata, monoqrafiyalara və dərsliklərə möhkəm surətdə daxil oldu. Müxtəlif avropa dillərində «kimya» sözü oxşar səslənməyə malikdir: ingiliscə – chemistry, almanca – chemie, fransızca – chimie, italyanca – chimica, ispan və portuqalca – quimica, isveç və danimarka dillərində – kemi, turkcə – kimya. Əgər fikir versək bütün sözlərdə «kem» və ya «kim» kökləri vardır. Bu faktları «kimya» sözünün mənşəyinin tapılmasında istinad nöqtəsi kimi qəbul etmək olarmı? Məhz tarixçilər də belə mühakimə edirdilər. Onların bir neçəsi qeyd edirdi ki, «kimya» sözü qədim yunan dilinin bir neçə sözü ilə həmahəngdir. Məsələn təbabətə və əczaçılığa dair əlyazmalarda rast gəlinən «kimos» və ya «kümos» sözləri «sərbəst» mənasını verirdi. «Kima» və ya «küma» sözəlri isə «tökmə» kimi tərcümə olunurdu. Məntiqi nəticə kimi ehtimal etmək olar ki, ilk əvvəllər «kimya», «metalların əridilməsi və tökməsi sənəti» idi? «Kimevsis» sözünün mənası isə «qarışdırma»dır ki, bu əməliyyat da bir çox kimyəvi proseslərdə geniş istifadə olunur. Belə ki, bu söz də tam hüquqla «kimya» sözünün sələfi ola bilər. Digər tədqiqatçılar «kimya» anlayışının vətənini Qədim Misiri hesab edirlər. «Kömi» («kümi») sözü ölkənin öz adı kimi işlənirdi, bundan başqa, qaratorpaq – məhsuldar Nil vadisi lilinin torpağı mənasını verirdi (maraqlıdar ki, oxşar söz olan «qumus» latın dilində «torpaq deməkdir»). Bu nöqteyi-nəzəri elmlərin tarixi ilə məşğul olmuş məşhur fransız kimyaçısı Marselen Bertlo və onun əməkdaşları müdafiə edirdilər. Onlar təsdiq edirdilər ki, «kimya» yerin təkini öyrənən biliklər sahəsidir. Hətta belə bir cazibədar fərziyyə irəli sürülürdü ki, «kimya» sözü qədim çin dilində «qızıl» mənasını verən «kim» sözündən yaranmışdır. Müasir kimya məvhumuna bu və ya digər dərəcədə daha yaxın olan «kimeya» sözünü IV əsrin ikinci yarısında ilk dəfə olaraq yunan filosofu və təbiətşünası Zosima Panopolitanski (o, Misir şəhəri Panopolisdə anadan olmuşdur) işlətmişdir. Həmin anlayışla Zosima «şirənin məhlula çıxarılması», «meyvə şirəsindən spirtli içki hazırlanması» proseslərini adlandırmışdır. |
Məhs bu səbəbə görə bəsit maddələr elementlərdən
sayca çoxdur.Bəsit maddələr isə öz növbəsində birləşərək
kimyəvi birləşmələri
yəni mürəkkəb
maddələri əmələ gətirir.
ELEMENT VƏ BİRLƏŞMƏLƏR
Eyni növ atomlardan əmələ gələn saf maddəyə element
deyilir. Metal, qeyri metal və təsirsiz qazlar elementdir.
Elementlərin xassələri:
Homogendir (xassələri hər yerdə eynidir).
Sabit ərimə və qaynama temperaturuna malikdir.
ən kiçik hissəciyi atomdur.
Kimyəvi və fiziki üsullarla daha bəsid maddələrə ayrılmır.
Tək atomlu (Al) və ya molekul (N2) halında olur.
Müəyyən simvollarla göstərilir. Latınca adlarının ilk hərfləri simvol kimi istifadə olunur.
İki və daha çox elementin bir-biri ilə xassələrini dəyişərək əmələ gətirdiyi yeni saf maddəyə birləşmə deyilir.
Birləşmələrin xassələri:
Homogendir
Sabit ərimə və qaynama temperaturu var.
Müxtəlif növ element atomlarından əmələ gəlir. Bu elementlərin kimyəvi xassələri dəyişir.
Yalnız kimyəvi üsullarla tərkib hissələrinə ayrılır.
Birləşmələri əmələ gətirən element atomları sabit kütlə nisbətində birləşir.
ən kiçik hissəciyi molekuldur.
Kimyəvi formullarla göstərilir.
Elementlərin xassələri:
Homogendir (xassələri hər yerdə eynidir).
Sabit ərimə və qaynama temperaturuna malikdir.
ən kiçik hissəciyi atomdur.
Kimyəvi və fiziki üsullarla daha bəsid maddələrə ayrılmır.
Tək atomlu (Al) və ya molekul (N2) halında olur.
Müəyyən simvollarla göstərilir. Latınca adlarının ilk hərfləri simvol kimi istifadə olunur.
İki və daha çox elementin bir-biri ilə xassələrini dəyişərək əmələ gətirdiyi yeni saf maddəyə birləşmə deyilir.
Birləşmələrin xassələri:
Homogendir
Sabit ərimə və qaynama temperaturu var.
Müxtəlif növ element atomlarından əmələ gəlir. Bu elementlərin kimyəvi xassələri dəyişir.
Yalnız kimyəvi üsullarla tərkib hissələrinə ayrılır.
Birləşmələri əmələ gətirən element atomları sabit kütlə nisbətində birləşir.
ən kiçik hissəciyi molekuldur.
Kimyəvi formullarla göstərilir.
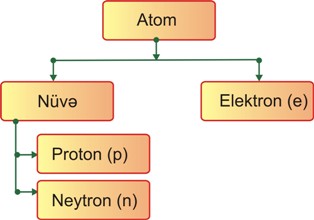
Atomun quruluşu
 Elementin kimyəvi xassələrini özündə daşıyan ən
kiçik hissəciyi atom adlanır.
Elementin kimyəvi xassələrini özündə daşıyan ən
kiçik hissəciyi atom adlanır.Hissəciyin yükü və kütləsini aşağıdakı kimi göstərmək olar:
Proton sayı elementin dövri sistem cədvəlindəki yerini və nüvənin müsbət yükünü müəyyən edir:
Proton sayı = Nüvə yükü = Sıra nömrəsi
13Al elementi üçün:
Proton sayı =13
Nüvə yükü =13
Sıra nömrəsi =13 kimidir.
Ø Atomun kütlə ədədi – A, proton və neytron sayı arasında əlaqə belədir:
A=Proton sayı + Neytron sayı
Ø Neytral atomda proton və elektron sayı bərabərdir:
proton sayı = elektron sayı
Deməli:
– atomu üçün:
Proton sayı =15
Nüvə yükü =+15
Sıra nömrəsi =15
Elektron sayı =15
Neytron sayı =16 kimidir.
Dövrü qanun
Dövri qanun aşağıdakı kimi ifadə olunur:
Kimyəvi elementlərin, eləcə də onların əmələ gətordiyi bəsid və mürəkkəb maddələrin forma və xassələri atomların nüvə yükünün artmasından dövri surətdə asılıdır.
Dövri qanunun qrafik təsviri dövri sistem cədvəli adlanır.
Dövri sistem cədvəli:
dövrlərdən – üfiqi yerləşmiş sıralardan və
qruplardan – şaquli yerləşmiş sütunlardan ibarətdir.
Dövrlər sıralara, qruplar isə əsas (A) və əlavə (B) yarımqruplara bölünür.
Cədvəlin qısa və uzun forması var.
Qısa formada:
7 dövr
10 sıra
8 qrup
I, II, və III dövrlər kiçik, qalan dövrlər isə böyük dövrlər adlanır.
Kimyəvi elementlərin, eləcə də onların əmələ gətordiyi bəsid və mürəkkəb maddələrin forma və xassələri atomların nüvə yükünün artmasından dövri surətdə asılıdır.
Dövri qanunun qrafik təsviri dövri sistem cədvəli adlanır.
Dövri sistem cədvəli:
dövrlərdən – üfiqi yerləşmiş sıralardan və
qruplardan – şaquli yerləşmiş sütunlardan ibarətdir.
Dövrlər sıralara, qruplar isə əsas (A) və əlavə (B) yarımqruplara bölünür.
Cədvəlin qısa və uzun forması var.
Qısa formada:
7 dövr
10 sıra
8 qrup
I, II, və III dövrlər kiçik, qalan dövrlər isə böyük dövrlər adlanır.

İzotoplar
(+) və (–) atom və ya atom qruplarına ion deyilir.
Ø Atom elektron verdikdə (+) yüklü ion əmələ gəlir – kation adlanır.
+n ionun yüküdür.
Ø Atom elektron aldıqda (–) yüklü ion əmələ gəlir – anion adlanır.
– m ionun yüküdür.
İzotop
Nüvə yükü – proton sayı eyni, kütlə ədədi fərqli olan atom növləri izotop adlanır.
bir-birinin izotopudur.
Ø İzotop atomların kimyəvi xassələri eyni, fiziki xassələri müxtəlifdir.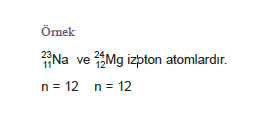
İzoton
Neytron cayı eyni, nüvəsinin yükü və kütlə ədədi fərqli olan atomlara izoton atomlar deyilir.
atomlarının hər ikisində 16 neytron olub izoton atomlardır.
İzobar
Atom kütləsi eyni, proton və neytronların cayı fərqli olan atomlar izoton adlanır.
atomları izobardır.
İzoelektron
Elektron sayı eyni olan atom ionlar izoelektrondur.
ionları izoelektrondur.
Ø Atom elektron verdikdə (+) yüklü ion əmələ gəlir – kation adlanır.
+n ionun yüküdür.
Ø Atom elektron aldıqda (–) yüklü ion əmələ gəlir – anion adlanır.
– m ionun yüküdür.

İzotop
Nüvə yükü – proton sayı eyni, kütlə ədədi fərqli olan atom növləri izotop adlanır.
bir-birinin izotopudur.
Ø İzotop atomların kimyəvi xassələri eyni, fiziki xassələri müxtəlifdir.
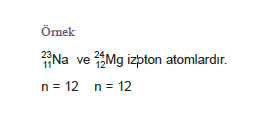
İzoton
Neytron cayı eyni, nüvəsinin yükü və kütlə ədədi fərqli olan atomlara izoton atomlar deyilir.
atomlarının hər ikisində 16 neytron olub izoton atomlardır.

İzobar
Atom kütləsi eyni, proton və neytronların cayı fərqli olan atomlar izoton adlanır.
atomları izobardır.
İzoelektron
Elektron sayı eyni olan atom ionlar izoelektrondur.
ionları izoelektrondur.
Qarışıqlar
İki və daha çox qarışıq maddənin kimyəvi
xassələrini itirmədən əmələ gətirdiyi sistem qarışıq adlanır.
Eynicinsli qarışıqlar
Xassələri hər yerdə eyni olan qarışıqlardır. Tərkibindəki hissəciklər gözlə və ya optik cihazlarla görünmür. Buraya daxildir:
Məhlullar (şəkərin suda məhlulu)
Ərintilər (bürünc, polad, çuqun)
Qaz qarışıqları (hava, tüstü)
Müxtəlifcinsli qarışıqlar
Xassələri hər yerdə eyni olmayan və tək bir maddə kimi görünməyən qarışıqlardır. Buraya daxildir:
Suspenziya: bərk-maye qarışığıdır. Təbaşir tozu-su kimi
Emulsiya: maye-maye qarışığıdır. Maye yağ-su, süd və s. kimi.
Qarışıqların xassələri:
Tərkibindəki maddələrin xassələri dəyişmir.
Fiziki üsullarla tərkib hissələrinə ayrəlır.
Ərimə və qaynama temperaturları sabit deyil.
Formulları yoxdur.
Tərkibi sabit deyil.
Eynicinsli qarışıqları ayırmaq üçün:
Buxarlandırma
Kristallaşdırma
Distillə
Xromotoqrafiya kimi üsullardan istifadə edilir.
Müxtəlifcinsli qarışıqları ayırmaq üçün: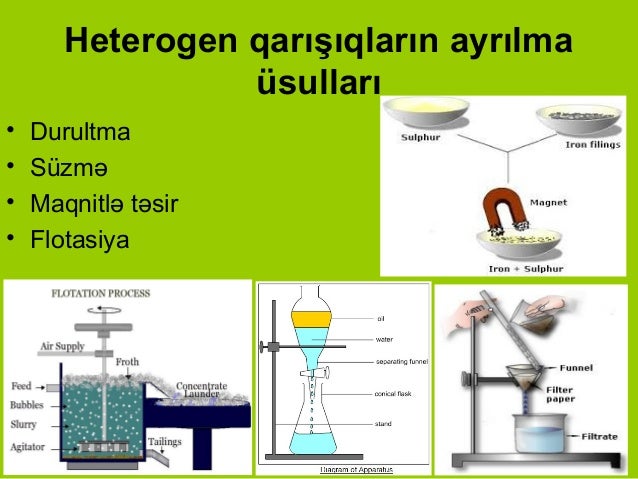
Durultma
Süzmə
Maqnitlə təsir etmə üsullarından istifadə edilir.
Eynicinsli qarışıqlar
Xassələri hər yerdə eyni olan qarışıqlardır. Tərkibindəki hissəciklər gözlə və ya optik cihazlarla görünmür. Buraya daxildir:
Məhlullar (şəkərin suda məhlulu)
Ərintilər (bürünc, polad, çuqun)
Qaz qarışıqları (hava, tüstü)
Müxtəlifcinsli qarışıqlar
Xassələri hər yerdə eyni olmayan və tək bir maddə kimi görünməyən qarışıqlardır. Buraya daxildir:
Suspenziya: bərk-maye qarışığıdır. Təbaşir tozu-su kimi
Emulsiya: maye-maye qarışığıdır. Maye yağ-su, süd və s. kimi.
Qarışıqların xassələri:
Tərkibindəki maddələrin xassələri dəyişmir.
Fiziki üsullarla tərkib hissələrinə ayrəlır.
Ərimə və qaynama temperaturları sabit deyil.
Formulları yoxdur.
Tərkibi sabit deyil.
Eynicinsli qarışıqları ayırmaq üçün:
Buxarlandırma
Kristallaşdırma
Distillə
Xromotoqrafiya kimi üsullardan istifadə edilir.
Müxtəlifcinsli qarışıqları ayırmaq üçün:

Durultma
Süzmə
Maqnitlə təsir etmə üsullarından istifadə edilir.

Fiziki və kimyəvi hadisələr.
Bir maddənin başqa maddə ilə
çevrilməsi ilə nəticələnməyən hadisələrə fiziki hadisələr deyilir.
Bu zaman maddənin yalnız aqreqat halı və ya forması dəyişir.
Bir maddənin başqa maddə ilə çevrilməsi ilə nəticələnən hadisələr kimyəvi hadisələr adlanır. Bu zaman başlanqıc maddədən yeni maddələr əmələ gəlir. Kimyəvi hadisələrə kimyəvi reaksiyalar deyilir. Kimyəvi reaksiyaları bəzi xarici əlamətlərinə görə təyin etmək olar:
Rəng dəyişməsi
Çöküntü alınması
Qöxunun əmələ gəlməsi
Qaz əmələ gəlməsi
Kimyəvi hadisələr həmişə fiziki hadisələrlə müşayiət olunur. Məsələn, təbii qazın yanması zamanı karbon qazı və suyun əmələ gəlməsi (kimyəvi hadisə) ilə yanaşı işıq və istilik ayrılır (fiziki hadisə).
Bu zaman maddənin yalnız aqreqat halı və ya forması dəyişir.
Bir maddənin başqa maddə ilə çevrilməsi ilə nəticələnən hadisələr kimyəvi hadisələr adlanır. Bu zaman başlanqıc maddədən yeni maddələr əmələ gəlir. Kimyəvi hadisələrə kimyəvi reaksiyalar deyilir. Kimyəvi reaksiyaları bəzi xarici əlamətlərinə görə təyin etmək olar:
Rəng dəyişməsi
Çöküntü alınması
Qöxunun əmələ gəlməsi
Qaz əmələ gəlməsi
Kimyəvi hadisələr həmişə fiziki hadisələrlə müşayiət olunur. Məsələn, təbii qazın yanması zamanı karbon qazı və suyun əmələ gəlməsi (kimyəvi hadisə) ilə yanaşı işıq və istilik ayrılır (fiziki hadisə).

Məhlullar
Məhlulların məlum olan bütün
növlərini dispers sistemlərə aid edirlər. Bir maddənin kiçik hissəciklər
şəklində başqa maddə mühitində paylanmasından alınan sistemə dispers sistem
deyilir. Paylanan maddə dispers faza, mühit isə dispers mühit adlanır
Aqreqat halına görə məhlullar maye, bərk, qaz halıda olurlar. Məsələn: duzların suda məhlulu, mis ilə nikelin ərintisi,qaz qarışığı məhluldur.
Təbiətdə və texnikada maye məhlulların rolu böyükdür.Təbii sular,qan,limfa və fizioloji mayelər məhluldur;qidanın mənimsənilməsi onun məhlula keçməsi nəticəsində mümkün olur;kimyəvi çevrilmələrin çoxu mühiti maye olan müxtəlif məhlullarla bağlıdır.Həll olan maddə və həlledici eyni aqreqat halında olduqda çoxluq təşkil edən maddə həlledici hesab edilir.
Həqiqi məhlullardan əsas xüsusiyətlərindən biri odur ki,onlar həllolan maddə ilə həlledicinin sadəcə olaraq toxunmasından əmələ gəlir.Bu isə öz-özünə baş verən qarşılıqlı diffuziya prosesi ilə əlaqədardır.Qarışdırma,çalxalama və başqa mexaniki təsir isə məhlulun əmələgəlmə prosesini yalnız sürətləndirir.
Maddənin həllolma qabiliyyəti onun müəyyən həlledicidə həll olması xassəsidir.Həllolma qabiliyyəti müəyyən temperaturda maddənin 100 q həlledicidə həll olan maksimum miqdarı ilə ifadə olunur.
Suda həllolmalarına görə bütün maddələri 3 qrupa bölürlər:yaxşı həll olan ,pis həll olan,və praktiki olaraq həll olmayan maddələr.
Maddələrin suda həll olması ilk növbədə onun təbiətindən asılıdır.Müəyyən edilmişdir ki,qeyri-polyar və ya az polyar həlledicilərdə elə maddələr yaxşı həll olur ki,onların molekulları qeyri-polyar və ya az polyar olsun.Belə həlledicilərdə polyarlığı çox olan maddələr az, ion quruluşlu olan maddələr isə praktiki olaraq həll olmur.Əksinə ,polyarlıq dərəcəsi nisbətən çox olan həlledicilər polyar və ion tipli maddələri yaxşı,qeyri-polyar maddələri isə pis həll edir.
Bərk maddələrdən nitrat vı nitritlər,ammonium və qələvi metalların bütün duzları,sulfat turşusunun dəmir,manqan,sink,aluminium və mislə əmələ gətirdiyi duzlar suda yaxşı həll olur.Sulfat turşusunun barium və qurquşunla ,sulfid turşusunun isə ağır metallarla əmələ gətirdiyi duzlar suda praktiki olaraq həll olmur.
Temperatur artıqda bəzi bərk maddələrin,məsələn,kalium-nitratın ,ammonium-nitratın həll olma qabiliyyəti artır.
Raul prinsipləri
Qapalı qabda mayenin buxarlanması ilə buxarın kondesləşərək yeniden mayeyə çevrilməsi arasında tarazlıq yarandıqda maye üzərindəki buxara doymuş buxar deyilir.Buxarlanma endotemik proses olduğundan,Le-Şateyle prinsipinə əsasən,temperaturun artması buxarəmələgəlmə prosesini sürətləndirir və buna görə də buxarın təzyiqi artır.
Fransız alimi F.M.Raul uçucu olmayan qeyri-elektrolitlərin duru məhlularının buxar təzyiqini öyrənərək 1887-ci ildə qanun vermişdir:
Həlledicinin məhlul üzərindəki buxar təzyiqinin nisbi azalması, həll olan maddənin mol sayının məhlulda olan molların ümumi sayına olan nisbətinə bərabərdir.
Raul müəyyən etmişdir ki,buxar təzyiqinin nisbi azalması 0C ilə 20C arasında temperaturdan asılı deyildir.
Uçucu olmayan qeyri-elektrolitlərin duru məhlulları üzərində həlledicinin buxar təzyiqinin nisbi azalması həll olan maddənin mollarının sayı ilə düz mütənasibdir.
Raulun 1-ci qanunu yalnız uçucu olmayan qeyri-elektrolitlərin duru məhlulları üçün doğrudur.
RAULUNN 2-Cİ QANUNU
Həllediciyə nisbətn məhlulların buxar təzyiqinin azalması ilə əlaqədar olaraq,onların donma və qaynama temperaturu da dəyişir.Belə ki,məhlul saf həllediciyə nisbətən aşağı temperaturda donur və yüksək temperaturda qaynayır.Maddənin eyni vaxtda həm maye,həm də bərk halda mövcud olduğu temperatura donma teperaturu deyilir.Lakin hər iki fazanın birlikdə qala bilməsi üçün həmin temperaturda onların buxar təzyiqləri bərabər olmalıdır.
Məhlulların donma və qaynama temperaturunu öyrənərək,Raul aşağıdakı 2-ci qanununu vermişdir:
Donma temperaturunun azalması və qaynama temperaturunun artması məhlulun molyar qatılığı ilə düz mütənasibdir.
Aqreqat halına görə məhlullar maye, bərk, qaz halıda olurlar. Məsələn: duzların suda məhlulu, mis ilə nikelin ərintisi,qaz qarışığı məhluldur.
Təbiətdə və texnikada maye məhlulların rolu böyükdür.Təbii sular,qan,limfa və fizioloji mayelər məhluldur;qidanın mənimsənilməsi onun məhlula keçməsi nəticəsində mümkün olur;kimyəvi çevrilmələrin çoxu mühiti maye olan müxtəlif məhlullarla bağlıdır.Həll olan maddə və həlledici eyni aqreqat halında olduqda çoxluq təşkil edən maddə həlledici hesab edilir.
Həqiqi məhlullardan əsas xüsusiyətlərindən biri odur ki,onlar həllolan maddə ilə həlledicinin sadəcə olaraq toxunmasından əmələ gəlir.Bu isə öz-özünə baş verən qarşılıqlı diffuziya prosesi ilə əlaqədardır.Qarışdırma,çalxalama və başqa mexaniki təsir isə məhlulun əmələgəlmə prosesini yalnız sürətləndirir.
Maddənin həllolma qabiliyyəti onun müəyyən həlledicidə həll olması xassəsidir.Həllolma qabiliyyəti müəyyən temperaturda maddənin 100 q həlledicidə həll olan maksimum miqdarı ilə ifadə olunur.
Suda həllolmalarına görə bütün maddələri 3 qrupa bölürlər:yaxşı həll olan ,pis həll olan,və praktiki olaraq həll olmayan maddələr.
Maddələrin suda həll olması ilk növbədə onun təbiətindən asılıdır.Müəyyən edilmişdir ki,qeyri-polyar və ya az polyar həlledicilərdə elə maddələr yaxşı həll olur ki,onların molekulları qeyri-polyar və ya az polyar olsun.Belə həlledicilərdə polyarlığı çox olan maddələr az, ion quruluşlu olan maddələr isə praktiki olaraq həll olmur.Əksinə ,polyarlıq dərəcəsi nisbətən çox olan həlledicilər polyar və ion tipli maddələri yaxşı,qeyri-polyar maddələri isə pis həll edir.
Bərk maddələrdən nitrat vı nitritlər,ammonium və qələvi metalların bütün duzları,sulfat turşusunun dəmir,manqan,sink,aluminium və mislə əmələ gətirdiyi duzlar suda yaxşı həll olur.Sulfat turşusunun barium və qurquşunla ,sulfid turşusunun isə ağır metallarla əmələ gətirdiyi duzlar suda praktiki olaraq həll olmur.
Temperatur artıqda bəzi bərk maddələrin,məsələn,kalium-nitratın ,ammonium-nitratın həll olma qabiliyyəti artır.
Raul prinsipləri
Qapalı qabda mayenin buxarlanması ilə buxarın kondesləşərək yeniden mayeyə çevrilməsi arasında tarazlıq yarandıqda maye üzərindəki buxara doymuş buxar deyilir.Buxarlanma endotemik proses olduğundan,Le-Şateyle prinsipinə əsasən,temperaturun artması buxarəmələgəlmə prosesini sürətləndirir və buna görə də buxarın təzyiqi artır.
Fransız alimi F.M.Raul uçucu olmayan qeyri-elektrolitlərin duru məhlularının buxar təzyiqini öyrənərək 1887-ci ildə qanun vermişdir:
Həlledicinin məhlul üzərindəki buxar təzyiqinin nisbi azalması, həll olan maddənin mol sayının məhlulda olan molların ümumi sayına olan nisbətinə bərabərdir.
Raul müəyyən etmişdir ki,buxar təzyiqinin nisbi azalması 0C ilə 20C arasında temperaturdan asılı deyildir.
Uçucu olmayan qeyri-elektrolitlərin duru məhlulları üzərində həlledicinin buxar təzyiqinin nisbi azalması həll olan maddənin mollarının sayı ilə düz mütənasibdir.
Raulun 1-ci qanunu yalnız uçucu olmayan qeyri-elektrolitlərin duru məhlulları üçün doğrudur.
RAULUNN 2-Cİ QANUNU
Həllediciyə nisbətn məhlulların buxar təzyiqinin azalması ilə əlaqədar olaraq,onların donma və qaynama temperaturu da dəyişir.Belə ki,məhlul saf həllediciyə nisbətən aşağı temperaturda donur və yüksək temperaturda qaynayır.Maddənin eyni vaxtda həm maye,həm də bərk halda mövcud olduğu temperatura donma teperaturu deyilir.Lakin hər iki fazanın birlikdə qala bilməsi üçün həmin temperaturda onların buxar təzyiqləri bərabər olmalıdır.
Məhlulların donma və qaynama temperaturunu öyrənərək,Raul aşağıdakı 2-ci qanununu vermişdir:
Donma temperaturunun azalması və qaynama temperaturunun artması məhlulun molyar qatılığı ilə düz mütənasibdir.






Ela👍
YanıtlaSilela
YanıtlaSilQüzel
YanıtlaSilSüper
YanıtlaSil