Kimyanın əsas xassələri

Kimyəvi tədqiqat zamanı müşahidə edilən hadisələri, eləcə də konkret
halları izah etmək məqsədilə çoxlu sayda qanunauyğunluqlar müəyyən olunmuş,
qaydalar, prinsiplər verilmiş və nəzəriyyələr irəli sürülmüşdür. Bunlar sayca
çox olmaqla bərabər, elələri vardır ki, yalnız bir neçə konkret hala tətbiq
oluna bilir. Lakin bizim məqsədimizə uyğun olaraq burada kimya elminin ən ümumi
qanunları və qanunauyğunluqları verilmişdir:
İndi isə ətraflı məlumat verək

Atom molekul təliminin yaranmasında rus alimi
M.V.Lomonosovun rolu böyük olmuşdur. Bu təlim 1860-cı ildə Karlsrue şəhərində
kimyaçıların beynəlxalq qurultayında qəbul edilmişdir.
Atom-molekul təliminin əsas
müddəaları aşağıdakılardır:
1.
Maddələr
molekulyar və qeyri-molekulyar quruluşlu olurlar.
2.
Bərk halda
molekulyar quruluşlu maddələrin kristal qəfəsinin düyünlərində molekullar
yerləşir.
3.
Molekullar
arasında ölçüləri maddələrin aqreqat halından və temperaturundan asılı olan
boşluqlar vardır.
4.
Molekullar daim
hərəkətdədir, molekulların hərəkət sürəti temperaturla düz mütənasibdir.
5.
Molekullar
arasında qarşılıqlı cazibə və itələmə qüvvəsi mövcuddur.
6.
Molekullar
fiziki hadisələr zamanı dəyişmirlər, lakin kimyəvi reaksiyalarda müəyyən
dəyişikliyə məruz qalırlar.
7.
Molekullar
atomlardan təşkil olunmuşdur, atomlar da molekullar kimi daim hərəkətdədir.
8.
Bir atom növü
digərindən öz kütləsinə, ölçüsünə, elementar zərrəciklərin sayına və ölçüsünə
görə fərqlənir.
9.
Qeyri-molekulyar
quruluşlu maddələrin kristal qəfəsinin düyünlərində molekullar yox, atom və
ionlar yerləşir.

XIX əsrin
başlanğıcına qədər kimyada müxtəlif maddələrin çəki tərkibi haqqında böyük
təcrübi material toplanmışdı. Fransız alimi J.Prust bu materialları
ümumiləşdirdikdə belə bir nəticəyə (1799-1808) gəlmişdir: "birləşmə ...
elə bir məhsuldur ki, təbiət ona sabit tərkib vermişdir".
Prustun kəşf etdiyi tərkibin sabitliyi qanunu belə ifadə
olunur: hər bir kimyəvi birləşmə, alınması üsulundan asılı olmayaraq, tərkibcə
sabitdir, yəni həmişə bir-biri ilə tam müəyyən çəki nisbətində birləşmiş eyni
elementlərdən ibarətdir.
Kimyanın sonrakı inkişafi göstərdi ki, həm sabit
tərkibli, həm də dəyişkən tərkibli maddələr mövcuddur. Dəyişkən tərkibə malik
olan qeyri-molekulyar quruluşlu Prust qanununa tabe deyillər. Odur ki, tərkibin
sabitliyi qanununu daha dəqiq belə ifadə etmək olar:
Molekulyar quruluşlu istənilən saf maddə alınma
üsulundan asılı olmayaraq sabit vəsfi və miqdari tərkibə malikdir.

Maddə kütləsinin saxlanması qanunu 1748-ci ildə
rus alimi Lomonosov tərəfində nəzəri şəkildə kəşf edilib. Lomonosov özünün
molekulyar-atomistik təsəvvürləri əsasında belə bir ümumi nəticəyə gəlmişdir:
"... təbiətdə baş verən bütün dəyişikliklərdə hər hansı cisimdən nə qədər
maddə alınırsa, eyni miqdarda maddə başqa cismə əlavə olunur. Deməli, bir yerdə
materiya azalırsa, başqa bir yerdə əlavə olunur...". 1756-cı ildə dəqiq
tədqiqat üsulları tətbiq etməklə Lomonosov təcrübə yolu ilə sübut etdi ki,
kimyəvi çevrilmələrdə maddələrin ümumi çəkisi dəyişməyib olduğu kimi qalır.
Beləliklə, Lomonosov kimyanın əsas
qanunlarından biri olan kütlənin itməməsi qanununu kəşf etdi. 1789-cu ildə bu
qanun Lomonosovdan xəbərsiz fransız kimyaçısı Lavuazye tərəfindən müəyyən
edilmişdir. Bu qanun hazırda belə ifadə olunur: kimyəvi reaksiyaya daxil olan
maddələrin kütləsi həmin reaksiyada əmələ gələn maddələrin kütləsinə hmişə
bərabərdir.

Eyni şəraitdə (temperatur və təzyiq eyni olduqda)
müxtəlif qazların bərabər həcmlərində bərabər sayda molekul olur.
Eyni şəraitdə bərabər sayda
müxtəlif qaz molekulları eyni həcm tutur. Normal şəraitdə (0 0C
temperatur və təxminən 0,1 MPa təzyiqdə) istənilən qazın və ya qaz qarışığının
1 molunun həcmi təqribən 22,4 l olur.
Qazların 1 molunun normal
şəraitdəki (n.ş.) həcmi molyar həcm adlanır və VM-lə işarə olunur.
Müxtəlif şəraitdə qazın molyar
həcmi onun verilmiş həcminin verilmiş maddə miqdarına nisbəti kimidir: VM=V/ν
Qazların normal şəraitdəki sıxlığı
onun molyar kütləsinin molyar həcmə nisbətinə bərabərdir: ρ=M/VM
Eyni həcmdə götürülmüş qazların
sıxlıqları nisbəti, onların kütlələrinin nisbətinə bərabərdir: ρ1/ρ2=m1/m2
Eyni həcmdə götürülmüş qazlardan birinin
kütləsinin digərinin kütləsinə nisbəti, onların molyar kütlələri nisbətinə
nisbətinə bərbərdir: m1/m2=M1/M2
Bir qazın molyar kütləsinin digər
qazın molyar kütləsinə olan nisbəti, birinci qazın ikinci qaza görə nisbi
sıxlığı adlanır: D=M1/M2
Qazların nisbi sıxlığı çox vaxt
hidrogenə (M=2q/mol) və havaya (M=29q/mol) görə hesablanır.

Fransız alimi Gey-Lüssak qaz halında maddələr arasında
gedən kimyəvi reaksiyaları tədqiq edərkən, reaksiyaya daxil olan və reaksiya
nəticəsində əmələ gələn qaz halındakı maddələrin həcmlərini eyni təzyiq və eyni
temperaturda diqqətlə ölçmüşdür. Təcrübələr göstərmişdir ki, 1 həcm hidrogen 1
həcm xlorla birləşəndə 2 həcm hidrogen xlorid alınır, 2 həcm hidrogen və 1 həcm
oksigen - 2 həcm su buxarı əmələ gətirir.
Gey-Lüssak təcrübələrdən əldə
etdiyi bu məlumatı ümumiləşdirərək aşağıdakı həcmi nisbətlər qanununu irəli
sürmüşdür: dəyişməyən şəraitdə reaksiyaya daxil olan qaz halındakı maddələrin
hacmlərinin bir-birinə və əmələ gətirdikləri qaz halındakı maddələrin
həcmlərinə nisbətləri sadə tam ədədlərin nisbəti kimidir.

1789-cu ildə fransız kimyaçısı Lavuazye
elementləri 4 qrupa böldü: qazlar, qeyri-metallar, metallar və yer elementləri.
1817-ci ildə alman alimi Debereyner
oxşar elementləri qruplar şəklində birləşdirmiş və onları triadalar (üçlüklər)
adlandırmışdır.
1864-cü ildə ingilis alimi C.Nyulends
atom kütlələrinin artması ardıcıllğı ilə yeddi elementdən ibarət qruplar tərtib
etmiş və bu qruplarda hər 8-ci elementin əvvəlki qrupda birinci elementlə oxşar
xassələr göstərdiyini qeyd etmişdir. Nyulends bunu "oktav qanunu"
adlandırmışdır. Lakin bu qanun ilk 17 element üçün doğru idi.
Fransız alimi Şankurtua elementləri
tom kütlələrinin artması ilə silindrin ətrafında spiral şəklində düzmüşdür. Bu
zaman oxşar elementlər bir-birinin altında yerləşmişdir.
1869-cu ildə alman alimi Lotar Meyer
məlum elementləri atom kütlələrinə qarşı aom həcmlərinin artması ilə düzərək
onların xassələrinin dövri olaraq dəyişməsini müəyyənləşdirmiş və ilk dəfə belə
asılılığı göstərən qrafik tərtib etmişdir. O, oxşar elementlərin altı qruounu
göstərmişdir.
Rus alimi Mendeleyev o dövrdə məlum
olan 63 elementi atom kütlələrinin artması sırası ilə yerləşdirərək dövri
sistem cədvəli tərtib etmişdir.
Mendeleyev kəşf etdiyi dövri qanunu
aşağıdakı kimi ifadə etmişdir:
Bəsit maddələrin, eləcə də
elementlərin əmələ gətirdiyi kimyəvi birləşmələrin forma və xassələri onların
atom çəkilərinin (kütlələrinin) artmasından dövri surətdə asılıdır.
Dövri qanunun kəşfi və dövri
sistemin ilk variantının yaradılıma tarixi 1 mart 1869-cu ildir.
Mendeleyev bəzi hallarda bu
qanundan kənara çıxaraq elementlərin cədvəldə yerini onların atom kütlələrinin
artması ardıcıllığına deyil, xassələrinin qanunauyğun dəyişməsinə görə müəyyən
etmişdir.
Dövri qanunun inkişafı iki
mərhələyə bölünür:
1. Dövri sistemin ilk variantından atomun quruluşunun
kəşfinədək olan kimyəvi mərhələ;
2. 1913-cü ildən hal-hazıra kimi olan fiziki mərhələ.
1913-cü ildə ingilis alimi Mozli
müəyyən etmişdir ki, elementlərin xassələri onların nüvələrinin yükü ilə
bilavasitə müəyyən olunur. Dövri qanunun müasir ifadəsi belədir:
Kimyəvi elementlərin, habelə
onların əmələ gətirdiyi bəsit və mürəkkəb maddələrin xassələri atomların
nüvələrinin yükünün artmasından dövri surətdə asılıdır.

Termokimyanın iki əsas qanunu məlumdur.
Lavuazye-Laplas qanunu. 1784-cü
ildə kəşf edilmiş bu qanunun mahiyyəti aşağıdakı kimidir: hər bir kimyəvi
birləşmənin sadə tərkib hissələrinə parçalanması zamanı udulan istilik miqdarı əks
işarə ilə həmin birləşmənin bəsit maddələrdən əmələ gəlməsi zamanı ayrılan
istilik miqdarına bərabərdir.
Məsələn, 1 mol metanın karbon və
hidrogenə parçalanmasında 21,7 kkal istilik udulur. Bəsit maddələrdən 1 mol
metan əmələ gəldikdə də eyni miqdarda istilik əmələ gəlir (ayrılır). Buna
əsasən bu qanuna enerjinin itməməsi qanunu kimi də baxmaq olar.
Hess qanunu. Termokimyanın ikinci
əsas qanunu Hess tərəfindən 1840-cı ildə kəşf edilmişdir. Hess qanunu həm də
istilik cəminin sabitliyi qanunu adlanır. Bu qanun aşağıdakı kimi ifadə olunur:
Reaksiyanın istilik effekti yalnız
reaksiyaya daxil olan və nəticədə əmələ gələn maddələrin təbiəti və fiziki
halından asılı olaraq, reaksiyanın aralıq mərhələlərindən asılı deyildir.
Məsələn, karbon qazının bəsit
maddələrdən əmələ gəlməsinə ya onların qarşılıqlı təsirinin nəticəsi kimi
C+O2=CO2; ΔH1
və ya CO-nun əmələ gəlməsi ilə
əlaqədar olan mərhələli prosesin nəticəsi kimi
2C+O2=2CO;
ΔH2
2CO+O2=2CO2; ΔH3
baxıla bilər.
Hess qanununa görə bu üç prosesin
istilik effektləri arasındakı sadə nisbət aşağıdakı kimi göstərilə bilər:
ΔH1 +
ΔH2 = ΔH3
Termokimyəvi hesablamalarda bəsit
maddələrin normal şəraitdə (0 0C, 1 atm.) əmələgəlmə istiliyi
sıfır qəbul edilir.
Hess qanununun sabit təzyiq və
sabit həcmdə gedən kimyəvi proseslər üçün tətbiqi dha ciddi xarakter daşıyır.
Belə proseslər üçün Hess qanununa enerjinin itməməsi qanununun kimyəvi
reaksiyalara tətbiq olunan xüsusi halı kimi baxıla bilər.
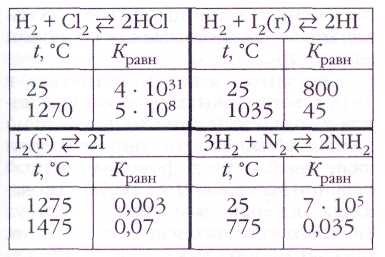
Müəyyən şəraitdə yaranmış reaksiya tarazlığı
həmin şərait sabit qaldıqda, istənilən qədər dəyişməz qalır. Lakin tarazlıqda
iştirak edən maddələrin qatılığının, sistemin temperatur və təzyiqinin
dəyişməsi ilə reaksiya tarazlığı dərhal pozulur və müəyyən istiqamətdə olmaqla
yerini dəyişir.
Müxtəlif amillərin təsiri ilə
reaksiya tarazlığının dəyişməsi tarazlığın yerdəyişməsi və ya tarazlığın
yönəlməsi adlanır.
Reaksiya tarazlığının yerdəyişməsi
reaksiyaya daxil olan maddələrin qatılığının artması ilə gedirsə, tarazlığın
sağ tərəfə yönəlməsi, reaksiya zamanı alınan maddələr qatılığının artması ilə
gedirsə, tarazlığın sol tərəfə yönəlməsi baş verir. Reaksiya tarazlığının
müəyyən amillərdən asılı olaraq, öz yerini dəyişmə xarakteri La-Şatelye
prinsipi ilə müəyyən edilir:
Tarazlıq halında olan sistemə
şəraitlərdən birinin dəyişməsi ilə nəticələnən xarici təsir göstərilərsə,
tarazlıq həmin təsir effektinin azalması istiqamətində yerini dəyişir.
Tarazlığın yerdəyişməsi zamanı
reaksiyaya daxil olan və ya reaksiya nəticəsində əmələ gələn maddələrin
qatılıqları nisbəti dəyişməyə başlayır və bu, yeni tarazlıq halı yaranana kimi
davam edir.
Tarazlıq halında olan sistemn
komponentlərindən birinin qatılığının artması tarazlığın həmin maddənin
istifadə olunduğu, yəni qatılığının azalması istiqamətində yerdəyişməsinə səbəb
olur. Qatılığın azaldılmasıyla isə tarazlığın yerdəyişməsi həmin maddənin
əmələ gəlməsi istiqamətində gedir.
Temperatur artdıqda tarazlıq
endotermik reaksiya, azaldıqda isə ekzotermik reaksiya istiqamətində yerini
dəyişir.
Təzyiqin artması ilə verilmiş
müəyyən şəraitdə kiçik həcm tutan maddənin əmələ gəlməsi üçün əlverişi şərait
yaradır. Başqa sözlə, təzyiqin artması ilə reaksiya tarazlığın yerdəyişməsi
həcmin azalması istiqamətində gedir.
Katalizatorlar dönən reaksiyalarda
düzünə və əksinə gedən kimyəvi reaksiyaların sürətini eyni dərəcədə
dəyişdirdiyindən, tarazlığın daha tez yaranmasına kömək edir, lakin tarazlıq
sabitinin qiymətinə və reaksiyaya daxil olan maddələrin tarazlıq qatılıqlarına
təsir etmir.

Bərk maddələrin mayelərdə həll olma prosesinin mahiyyəti
hələ XIX əsrin axırında öyrənilmiş və bu sahədə iki nəzəriyyə - fiziki və
kimyəvi nəzəriyyələr irəli sürülmüşdür.
Arrenius, Vant-Hoff və Ostvald
tərəfindən irəli sürülmüş fiziki nəzəriyyəyə əsasən məhlullara həll olan
maddənin həlledici mühitində sadəcə olaraq xırdalanması nəticəsində əmələ
gəlmiş qarışıq kimi baxılırdı. Qəbul edilirdi ki, məhlulun xassələri yalnız
verilmiş müəyyən həcmdə maddə molekullarının sayından asılıdır, həm də bu şərt
çox duru qeyri-elektrolit məhlulları üçün Raul və Vant-Hoff qanunlarında
ödənilirdi.
Məhlulların kimyəvi nəzəriyyəsi
Mendeleyev (1887) yaradılmış və sonralar Kabulkovun, Kistyakovskinin və
Kurnakovun işlərində inkişaf etdirilmişdir. Bu nəzəriyyənin mahiyyəti ondan
ibarətdir ki, məhlulda həll olan maddə və həlledici molekullar arasında
qarşılıqlı kimyəvi təsir baş verir və bunun nəticəsində yalnız məhlulda mövcud
ola bilən dəyişkən tərkibli davamsız birləşmələr əmələ gəlir. Həlledicin və
həll olan maddə molekullarının belə qarşılıqlı kimyəvi təsir prosesi
solvatlaşma, nəticədə əmələ gələn məhsul isə solvat adlanır. Həlledici su
olduğu halda isə həmin prosesə hidratlaşma, alınan məhsula hidrat deyilir.
Mendeleyevin bu nəzəriyyəsi
məhlulların kimyəvi nəzəriyyəsi və ya hidrat nəzəriyyəsi adlanır.

Elektrolitlərin Om qanununa tabe olmasına əsasən
Klauzius belə qərara gəlmişdir ki, elektrik enerjisi ionların məhlulda hərəkəti
zamanı istifadə olunur. Kolrauş müşahidə etmişdir ki, elektrolit məhlullar
durulaşdırıldıqda, onlar elektrik cərəyanını daha yaxşı keçirir. Vant-Hoff və
Raulun müəyyən etdikləri qanunlar turşu, əsas və duzların məhlullarına tətbiq
edilə bilmir.
Bütün bu məsələlər öz həllini
Svante Arreniusun elektrolitik dissosiasiya nəzəriyyəsində tapmışdır. İsveç
alimi S.Arrenius 1887-ci ildə müəyyən etmişdir ki, elektrolitlərin suda
məhlullarının donma temperaturunun azalması, qaynama temperaturunun artması və
onların elektriki keçirmə qabiliyyəti turşu, əsas və duz molekullarının suda
məhlullarında əks işarəli yükləri olan ionlara dağılmaq və ya dissosiasiya
etməsi ilə əlaqədardır. Elektrolit məhlullarında arasıkəsilmədən hərəkət edən
ionların olması bu məhlullarda elektrikkeçirmə qabiliyyətinin yaranmasına səbəb
olur.
Xaotik hərəkət edən əks yüklü
ionlar toqquşduqda bir-birini cəzb edir və ilkin molekulu əmələ gətirir. Bu
yolla ionlardan ilkin molekulların əmələ gəlməsi prosesi molyarizasiya adlanır.
Deməli, elektrolitik dissosiasiya dönən prosesdir:
KA ↔ K+ + A-
Arrenius nəzəriyyəsi ionlar ilə
həlledicinin molekulları arasında qarşılıqlı kimyəvi təsiri nəzərə
almadığından, o elektrolitlərin dissosiasiyasının mexanizmini aydınlaşdıra
bilməmişdir.
Əslində məhlulda elektrolitlərin dissosiasiyaya
uğraması həm onların, həm də həlledicinin təbiəti ilə bilavasitə əlaqədardır.
Elektrolitlər qüvvətli polyar və ya ion molekullardan ibarətdir. Həlledici isə
dielektrik sabiti yüksək olan müxtəlif maddələr ola bilər.
Kablukov göstərmişdir ki,
elektrolitin ionlara dissosasiya etməsinin əsas səbəbi onun polyar su
molekulları ilə qarşılıqlı təsiridir.
Əgər ion kristal şəbəkəsinə malik
olan maddə həll olursa, o birbaşa ionlara çevrilir; molekul kristal qəfəsli
maddə həll olduqda isə əvvəlcə kristalın ayrı-ayrı molekullara parçalanması baş
verir, sonra isə həmin molekullar öz ionlarına dissosiasiya edir. Eyni bir
maddənin müxtəlif həlledicilərdə ionlarına dissosiasiyası müxtəlif cür gedir.
Beləliklə, müxtəlif həlledicilərin ionlaşdırma qabiliyyəti eyni deyildir.
Tomson-Nernst qaydasına görə
həlledicinin ionlaşdırıcı qabiliyyəti ilə onun dielektrik sabiti arasında düz
mütənasiblik vardır. Qeyri üzvi maddələrin əsas həlledicisi olan suyun
dielektrik sabiti 81-ə bərabərdir, odur ki, su həlledici olduqda məhlulda
ionların bir-birini cəzbetmə qüvvəsi vakuumdakından 81 dəfə zəif olur.
İonlaşdırıcı həlledicilər polyar
molekullu birləşmələr olub, dipol əmələ gətirirlər.
Elektrolitlərin dissosiasiya
prosesinin daha effektli getməsinə həll olan və həlledici maddə molekulları
arasında hidrogen rabitələrin yaranması da müsbət təsir göstərir.

Üzvi kimya tarixində ən əhəmiyyətli rol oynamış nəzəriyyələrdən
biri olan quruluş nəzəriyyəsinin əsasını 1861-ci ildə rus alimi Butlerov
qoymuşdur. Nəzəriyyənin ən üstün cəhəti ondan ibarətdir ki, onda özündən
əvvəlki nəzəriyyələrin müsbət tərəfliəri və üzvi birləşmələr haqqında alman
alimi Kekule və şotland alimi Kuperin dəyərli fikirləri öz əksini tapmışdır.
Quruluş nəzəriyyəsinin əsas
müddəaları aşağıdakılardır:
1. Üzvi maddəni təşkil edən bütün atomlar bir-biri ilə
tam müəyyən ardıcıllıqla əlaqələnmişdirlər.
Molekulda atomların
"birləşmə" qaydasını və onların əlaqəsinin xarakterini Butlerov
kimyəvi quruluş adlandırmışdır. Hər maddənin yalnız ona xas olan bir kimyəvi
quruluşu vardır.
2. Maddələrin xassələri onun molekulunun tərkibi və
molekulun kimyəvi quruluşu, yəni onun atomlarının "birləşmə" qaydası
və kimyəvi əlaqələrinin xarakteri ilə müəyyən olunur.
Nəzəriyyənin bu bəndi vasitəsilə
Butlerov izomerlik hadisəsini izah etmişdir.
3. Maddələrin xassələrinə əsasən onun molekulunun
quruluşunu müəyyən etmək, həmçinin onun molekulunun quruluşuna
əsasən xassələrini əvvəlcədən söyləmək olar.
4. Üzvi maddələrin molekulunda olan atom və atom
qrupları bir-biri ilə həm bilavasitə, həm də müəyyən vasitə ilə qarşılıqlı
təsirdə olurlar. Odur ki, molekuldakı atom və atom qruplarının kimyəvi xassəsi (reaksiya
qabiliyyəti) onların molekuldakı mövqeyindən asılıdır. Bilavasitə
"birləşən" atom və atom qrupları bir-birinin reaksiya qabiliyyətinə
çox təsir göstərir.
Quruluş nəzəriyyəsi yaradılarkən bu
mülahizələr əldə rəhbər tutlmuşdur: 1) Üzvi birləşmələrdə karbon
dördvalentlidir (Kekule, Kolbe - 1857); 2) Karbonun bütün valentlikləri
eyniqiymətlidir; 3) karbon atomları bir-birilə birləşərək "atomlar
zənciri" əmələ gətirir (Kekule və Kuper - 1858).

Molekulun əmələ gəlməsini və quruluşunu,
kimyəvi rabitənin təbiətini və s. daha dəqiq izah etmək məqsədilə amerikan
alimi Polinqin təklifi üzrə elmə hibrid anlayışı daxil edilmişdir. Hibrid
anlayışının əsasını atomun birləşmə tərkibindəki vəziyyətində ayrı-ayrı ilkin
orbitalların müəyyən prinsiplər üzrə hibridləşməsi (ümumiləşməsi) təşkil edir.
Atomda ayrı-ayrı valent
yarımsəviyyələrin (kimyəvi əlaqədə iştirak edən yarımsəviyyə) "qarışması"
və nəticədə ümumi bir energetik səviyyə yaratması hadisəsi hibridləşmə adlanır.
Bu prosesdə "əmələ gələn" orbitallara hibrid
orbitallar, elektronlara isə hibrid elektronlar adı verilmişdir.
Əgər hibridləşmədə bir ədəd
s-orbital və üç ədəd p-orbital iştirak edibsə hibridləşmə forması sp3,
bir ədəd s-orbital və iki ədəd p-orbital iştirak edibsə hibridləşmə forması sp2 kimi
göstərilir. Hibridləşmə nəticəsində baş verən dəyişiklikləri ifadə etmək üçün
bəzən sp3, sp2, sp əvəzinə müvafiq olaraq, q4,
q3, q2 şərti işarələrindən istifadə olunur.
Hibridləşmədə s və p -orbitalları
ilə yanaşı d-orbitallar da iştirak edir.
Hibridləşmə prosesi müəyyən enerji
sərfi ilə əlaqədar olduğundan, o, orbitalların energetik xarakteristikasının
müəyyən yaxınlığı şəraitində baş verir. Bununla əlaqədar olaraq, müxtəlif
orbitalların hibridləşməsi bir qayda olaraq, onların arasında enerji fərqinin
az olduğu hallarda baş verir.
Atomda energetik səviyyələrin sayı
artdıqca, onların arasındakı energetik fərq tədricən azalır, odur ki,
d-orbitalların iştirakı ilə hibridləşmə əsasən ağır elementlərdə müşahidə
olunur.
Hibridləşmədə adətən daxili
d-orbitallar, bəzən isə xarici d-orbitallar iştirak edir.
Hibrid orbitallar daha effektiv
qapanır. Buna görə də, onların arasında əmələ gələn kimyəvi əlaqələr s- və ya
p- orbitalların əmələ gətirdiyi kimyəvi əlaqələrə nisbətən daha möhkəm olur.
Atomda energetik səviyyələrin elektronlarla
tamamlanması aşağıdakı prinsip və qaydalar üzrə baş verir:
Pauli prinsipi atom spektrlərinin tədqiqi əsasında
isveç alimi Pauli (1925) tərəfindən işlənib hazırlanmış və onun şərəfinə belə
adlandırılmışdır.
Pauli prinsipinə əsasən bir atomda
(və ya molekulda) bütün kvant ədədləri tamamilə eyni olan iki elektron belə ola
bilməz. Başqa sözlə, hər bir atomdan götürülmüş hər hansı iki elektron
bir-birindən heç olmasa bir kvant ədədinin qiymətinə görə fərqlənməlidir.
Məsələn, energetik halları (n, l, ml) eyni olan iki elektron bütün
hallarda spin kvant ədədinə görə bir-birindən fərqlənir. Belə elektronlar
energetik hallarına görə eyni olduqlarından, bir kvant qəfəsini tutur və
spinlərinə görə fərqləndiyinə görə əks istiqamətli oxlarla işarə
edilir:
Beləliklə, n, l və ml kvant
ədədlərinin eyni qiymətlərində bir kvant qəfəsində maksimum iki (əks-spinli)
elektron yerləşə bilər.

Atom spektrinin analizinə, xüsusilə spektr
xətlərinin maqnit sahəsində parçalanmasına (Zeyman effekti) əsasən alman alimi
Hund yarımsəviyyələrin elektronlarla tamamlanmasına dair müəyyən qayda irəli
sürmüşdür ki, bu da hazırda alimin şərəfinə Hund qaydası adlanır.
Hund qaydasına əsasən orbital kvant
ədədinin (l) verilmiş müəyyən qiymətində elektronlar kvant qəfəslərini elə
doldurmağa çalışır ki, nəticədə maksimum sayda qəfəs tutulmuş olsun. Başqa
sözlə, elektronlar yarımsəviyyədə orbitallar üzrə elə paylanır ki, spin
ədədlərinin cəmi mümkün maksimal qiymət ala bilsin.
Məsələn, p-yarımsəviyyədə 4
elektron iki variantda paylana bilərdi:
Beləliklə, hər bir yarımsəviyyənin
bütün kvant qəfəsləri əvvəlcə paralel spinli tək elektronlarla tamamlanır və
yalnız bundan sonra qəfəsdə həmin elektronların tədricən qapanması başlayır.
Məsələn, azot atomunda elektronların paylanması variantları:
2s
2p
mümkün hal; 2s
2p
qeyri-mümkün hal.
Hund qaydasının başqa bir mühüm
cəhəti ondan ibarətdir ki, baş kvant ədədinin verilmiş müəyyən qiymətində bir
yarımsəviyyə yuxarıda göstərilən qayda üzrə cüt elektronlarla tamamlanmamış
həmin prosesin eyni qayda ilə davamlı növbəti yarımsəviyyəyə keçmir.
Məsələn, karbon atomunda:
2s
2p
mümkün hal; 2s
2p
qeyri-mümkün hal

Minimum enerji prinsipinə görə atomda
elektronlar maksimal davamlılığa müvafiq gələn ən aşağı energetik səviyyələri
tutmağa çalışır.
Bununla əlaqədar olaraq, energetik
səviyyələrin elektronlarla tamamlanması K→L→M→N→O→P→Q, müəyyən bir energetik
səviyyə hüdudunda yarımsəviyyələrin elektronlarla tamamlanması isə s→p→d→f
ardıcıllığı üzrə getməlidir.
Energetik səviyyə və yarımsəviyyələrin elektronlarla
tamamlanmasına dair faktiki ardıcıllığı müəyyən etmək məqsədilə rus alimi
Kleçkovski empirik qayda irəli irəli sürmüşdür ki, buna əsasən energetik
halları yaxın olan yarımsəviyyələrdən baş və orbital kvant ədədlərinin ədədi
qiymətlərinin cəmi nisbətən az olan yarımsəviyyə daha əvvəl tamamlanmalıdır.
Məsələn, 4s-yarımsəviyyə üçün n=4 və l=0 olduğundan n+l=4, 3d-yarımsəviyyə üçün
isə n=3, l=2 olduğundan n+l=5 olur. Deməli, 3d-yarımsəviyyədən əvvəl
4s-yarımsəviyyə elektronla tamamlanmalıdır.
Atomda baş və orbital kvant
ədədlərinin ədədi qiymətlərinin cəmi eyni olan yarımsəviyyələr də mövcuddur: 4p
və 3d-yarımsəviyyələr. Kleçkovski qaydasına görə bunlardan baş kvant ədədi
kiçik olan yarımsəviyyə daha əvvəl dolmalıdır. Məsələn,
4f-yarımsəviyyə üçün n=4, l=3; n+l=7
5d-yarımsəviyyə üçün n=5, l=2; n+l=7, yəni əvvəl 4
f-yarımsəviyyə elektronlarla tamamlanır.
Homogen reaksiyaların sürəti reaksiyaya daxil
olan maddə molekullarının zaman vahidi ərzində görüşmələrinin (toqquşmalarının)
sayından asılıdır. Molekulların toqquşma sayı isə öz növbəsində reaksiyaya
daxil olan maddələrin qatılığından asılı olduğu üçün, reaksiya sürəti ilə maddə
qatılığı arasında asılılıq aşağıdakı kimi ifadə edilə bilər.
Verilmiş müəyyən sabit temperatur
şəraitində kimyəvi reaksiyanın sürəti reaksiyay daxil olan maddələrin
qatılıqları hasili ilə düz mütənasibdir. Sürətlə kütlə arasındakı bu asılılığın
xarakteri isveç alimləri Quldberq və Vaage (1867) tərəfindən müəyyən edilmiş və
kütlələrin təsiri qanunu adını almışdır.
Kütlələrin təsiri qanununa əsasən
ümumi
mA + nB = pC + qD
tənliyi ilə ifadə olunan kimyəvi reaksiyanın sürəti
aşağıdakı kimi göstərilə bilər:
v= k[A]m [B]n
burada v- reaksiyanın sürətini, [A]
və [B] isə müvafiq surətdə A və B maddələrinin molyar qatılığını göstərir.
k-mütənasiblik əmsalı olub, kimyəvi reaksiyanın sürət sabiti adlanır. k-nın
qiyməti reaksiyaya daxil olan maddələrin qatılığından asılı olmayıb, yalnız
onların təbiətindən və temperaturdan asılıdır.
Kütlələrin təsiri qanunu ideal qaz
qanunlarının qaz reaksiyalara tətbiqi həddində və həmçinin çox duru məhlullarda
baş verən reaksiyalara bilavasitə tətbiq oluna bilir. Digər şəraitlər üçün isə
bu qanunun tətbiqi bir qədər mürəkkəb xarakter daşıyır.

Bu qədər Məlumat verdiyiniz və əziyyət çəkib paylaşdığınız üçün Təşəkkür edirəm )))))
YanıtlaSilSalam. Menim bir sualım var. Bir mol maddede Avaqadro ədədi(Na) molekullar üçün ayrıdır , atomlar üçün ayrı ?
YanıtlaSilMəsələn bir mol Sulfat tursusunun Na ədədi 6.02 * 10 üstü 23 deyilmi ?
Sizin bu saytdan çox istifadə edirəm.Ona ğörə sizə çox çox təşəkkür edirəm
YanıtlaSil